がん巣は異なる種類の細胞
がん巣は異なる種類の細胞
がん治療が難しい理由は、がん自体が非常に複雑な疾患であるためです。
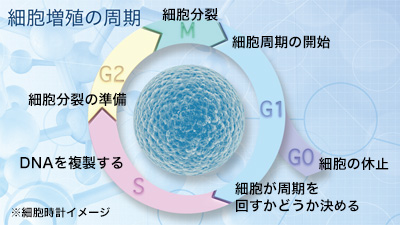
細胞のがん化は、多くの要因が関与しますが通常、遺伝子の変異の積み重ねによって引き起こされます。これにより、細胞増殖の周期で制御されている細胞の成長が制御を失い、異常な速度で増殖し始めます。
がんは、種類や個人差によって、その性質や進行のスピードが大きく異なります。早期がんと診断され完治を目指す外科手術を受けてもすでに転移している場合や、将来的にがん幹細胞により増悪・増殖し転移する可能性もあるケースも考えられます。
がん組織は、異なる種類の細胞の集まりなので、内部が空洞になっている臓器の内側の粘膜組織から発生する扁平上皮がん、各臓器の分泌腺組織の細胞から発生する腺がんをはじめ様々なタイプのがん種があります。 ゆっくり増殖する、おとなしいがんもあります。一方、急激に増大していくものもあります。また、がんが発生した直後から遠隔転移を起こして、急速に進行していくようなものもあります。抗がん剤は正常組織にもダメージを与えるため、投与量に限界があり、十分な効果が得られない場合があります
 病変の組織や細胞などの一部を採って顕微鏡などで調べる生検をおこない病理組織診断します。それによりがんの悪性度がわかります。
病変の組織や細胞などの一部を採って顕微鏡などで調べる生検をおこない病理組織診断します。それによりがんの悪性度がわかります。
がんの悪性度はがんの種類、タイプによって悪性度が違ってきます。 一般的には、がん細胞の組織の分化度が高いものは悪性度が低くて、逆に分化度が低いものは、悪性度が高いことが知られています。
細胞の分化度とは
同じ臓器から発生した同じタイプのがん種の中でも分化度の違いにによって悪性度が違います。転位を起こすがんは増殖・増悪するがん種で、転位巣の組織は原発巣より変異してリンパ管、 静脈等の脈管への侵襲、神経への浸潤をしてきたものです。浸潤がんでは,がん細胞の悪性度が高いと転移・再発の危険性が高くなります。
悪性度(グレード)は、1~3の3段階に分類され、原発の部位により「高分化」「中分化」「低分化」「未分化」などと表現します。脳腫瘍では1~4の4段階に分類されています。脳腫瘍の良性腫瘍ほとんどグレード1で、悪性腫瘍はグレード4です。
分化度は、がんが正常細胞とどの程度かけ離れているかの形態です。病理検査でがん細胞の分化を調べると、がん組織の細胞は個々の細胞の形が非常に不整になっています。細胞核の異型性が出て、細胞の構築も非常に乱れててきます。もとの正常細胞とどの程度かけ離れているかで分化度は決まってきます。
「分化」とはもともとの細胞が決められた機能を果たせるように成長していく過程のことです。 高分化ですと、比較的もとの組織に類似していますが、低分化あるいは未分化と呼ばれるようながんになってくると、もとの組織とはおよそかけ離れ細胞の形がほとんど見られない未熟組織像を呈するようになってきます。悪性度の評価することで治療効果の予測などを行います。
そのため、同じ臓器のがんでも、患者さんごとに異なる治療法が必要になる場合があります。
がん治療を行う医師は、患者さんのがんの種類、進行度合い、健康状態、年齢、などを総合的に考慮し、最適な治療法を選択しなければなりません。
さらに、がんはしばしば細胞内や遺伝子レベルでの変異によって引き起こされるため、がん細胞は、抗がん剤の抵抗性を獲得することがあります。このため、治療が成功したと思われた後にがんが再発することがあり、患者さんの治療計画を見直す必要が生じることもあります。
健康な細胞は正確な分裂サイクルを経て増殖しますが、がん細胞は分裂の制御を喪失し、異常な速度で増殖することがあります。この制御の喪失は、遺伝子の変異や細胞内のシグナル伝達経路の異常によって引き起こされます。
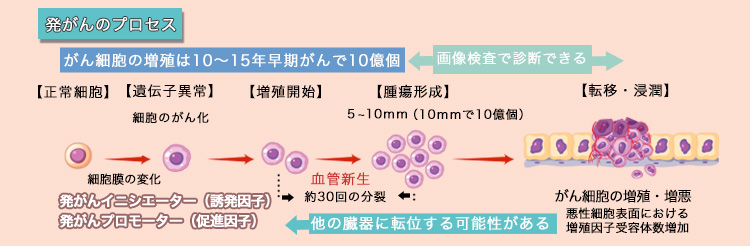
発がんのプロセス (5mm以下のがん巣は発見することはできない)
たった1個のがん細胞は10年から15年あるいはそれ以上の長い年月かけて何段階にもその過程で免疫から逃避するために遺伝子変異し、生命を脅かすまで増殖すると考えられています。がん細胞が無限に分裂出来るのはテロメア合成酵素が活性化して染色体末端構造の長さが短縮せずに、維持され続けることで、無限に増殖する能力を獲得してアポトーシス(細胞の自然死)しないからです。
また、がん細胞が2~3ミリ以上の大きさになるためには細胞増殖因子とよばれるタンパク質が増殖するシグナルを送ります。毛細血管を作る血管内皮細胞に働きかけ新しい血管(血管新生)を呼び込み酸素と栄養を吸収すると一気に増殖します。
増殖過程
1個のがん細胞の大きさは、十ミクロン(1ミリの100分の1程度)です。約20回の分裂で1ミリの塊になり、そのなかに約百万個のがん細胞あることになります。20回くらいの分裂過程は、腫瘍マーカー、最新のCT・MRI・PETなどの画像検査でもまだ異常影としてとらえることはできませんので、微小がんが存在していても診断はできません。
さらに約30回の分裂で約1センチの塊になり、そのなかには約10億個のがん細胞があります。
検診などで発見することができるようになります。5~8mmくらいで発見できることもあります。この時点でがんと診断できます。さらに、1センチのがんが 2センチになるには、3回の分裂、約1年半です。
最初の1個のがん細胞から40回の分裂で約10cmの塊で1kgの大きさになります。
【目次】
がん治療の現状 がん治療の難しい理由
「治るがん」「治らないがん」
転移するとがん悪液質の誘引になります
トルソー症候群よる脳卒中
がんに有効な薬剤は出現するか
早期発見の意味
がん細胞の多様性
がん発生に関わるタンパク質の抑制方法はまだ解明されていません。がん細胞の多様性のため、有効と思える薬剤を投与しても効く細胞と効かない細胞があります。抗がん剤治療で7〜8割のがん細胞は、死滅しますが必ず生き残るがん細胞もいます。
不均一ながん細胞集団の中には、特定の治療に対して抵抗性を持つ細胞が存在し、治療後にこれらの細胞が増殖することで治療抵抗性を引き起こします。抗がん剤から生き残ったがん細胞は、「薬剤耐性」を獲得しますので増悪、増殖しても最初の抗がん剤では対処することが難しくなります。
がん細胞は、DNA修復機構の欠陥や突然変異の蓄積により、時間と共に新しい遺伝的変異を獲得します。がん細胞の不均一性は、腫瘍内および腫瘍間でのがん細胞の多様性を指します。これは、がん治療において重要な課題であり、治療抵抗性や再発の原因となることが多いです。
がん細胞の増殖メカニズムについてはがん幹細胞を含めて未知の領域が多く今後の研究を待つよりないというのが現状です。 正常細胞の細胞分裂周期は厳密に増殖に関連するシグナル伝達経路により厳密に制御されています
 早期発見といわれている1cm位の大きさではがん細胞の塊は約10億個です。
早期発見といわれている1cm位の大きさではがん細胞の塊は約10億個です。
仮に10cm大の大きさのがん巣が人間の生命を脅かす大きさとして、約1cm位の固形がんでは細胞分裂の過程としては4分の3を経過した状態です。
3DCTなど最新の検査機器を使って検査をしても数ミリの固形がんは一般的には塊として、発見は出来ません。また、この状態では自覚症状もありません。
40回分裂して1kg(がん細胞の塊)大きさですから、分裂が約30回(5mm~10mm)以降でないと発見できないのです。このことは、早期であっても細胞レベルでは30回目以降の分裂ですので、はたしてその時点で本当に早期と言えるのか疑問に思えます。
ただし細胞分裂の過程は様々な要素がありますのですべて一定とは限りません。がん細胞のタイプにより分裂が驚くほど早いがん細胞もありますし、1年間たっても大きさがあまり変わらないがん細胞もあります。
悪性度が高いがん細胞(低分化、未分化型タイプ)ほど分裂の速度は速くなります。またがん化した1個のがん幹細胞の種類によって転移するかしないかが決まると考えられています。
がん細胞の成長の過程は、遺伝子、発がん物質などが関わっていると考えられますが、がん細胞の増殖のメカニズムについては、まだまだ未知の領域が多く、今後の研究を待つしかありません。
がんの罹患数と死亡数は、ともに増加し続けています
※臨床、基礎研究で長年にわたって研究しているのにかかわらず、がんの罹患率は、増加傾向が続いており今後増加することが確実に予想されます。結果的にがんは1981年以降ずっと日本人の死因第1位で、生涯に約2人に1人ががんと診断されています。
がんの年齢調整罹患率(高齢化の影響を除去するための、年齢調整)では、がんに罹患する人、死亡率は微減していることになっていますが、全く実感がありません。人口の高齢化が要因としても、がんの罹患数と死亡数は、ともに増加し続けています。またAYA世代(15歳から30歳代)までの罹患率は増えています。AYA世代の約8割が女性が占めているとの調査結果が公表されています。またX世代(42歳~57歳)でも増えています。
しかも難治性のがんも増えていますし、死亡率が減少している実感はなく激減への傾向は認められないです。年齢調整罹患率などの言葉も最初は使用していませんでした。
2019年に新たにがんと診断された方は男女合わせて999,075人。2021年にがんで死亡した人は381,505人(男性222,467人、女性159,038人)。2022年にがんで死亡した人は385,797人(男性223,291人、女性162,506人)です。※国立がん研究センター2024年3月発表
平成19年4月1日からがん対策基本法が施行されました。それでもがんの罹患者は増えています。それに伴い死亡者も増えています。国が進めている「がん研究10か年戦略」で掲げた「がんの罹患率と死亡率の激減」というテーマが達成されたとは言い難いです。
「治るがん」「治らないがん」固形がんの場合
 完治するがんとは
完治するがんとは
過去の多くの患者さんの症例経験により、治るがんとは、原発巣の部位の組織を完全に摘出できることが前提になります。
また、転移を起こしていても手術で切除、摘出できる範囲にしか転移していないがんのことをいいます。放射線療法でも同じことがいえます。
このようながんを「局在がん」または「限局がん」と呼ばれています。局在がんなら手術で摘出できれば治る可能性は非常に高くなり、5年経過した時点で完治したことになります。現時点で最良の治療法は、手術とほぼ決まっています。
難治性のがん
一方、治らないがんとは、どんな治療をしても治癒が不可能な転移を起こしてしまったものを指します。がんが複数の臓器に遠隔転移している場合、手術で摘出することはできません。
膵臓がんは、男女共に5年生存率はIII期でわずか5~8%しかなく難治性がんといわれています。膵臓は、胃の後ろ腹腔の奥にあります。初期症状がほとんどなく、自覚症状が現れる頃にはかなり進行してしまっているため早期発見が難しいがんです。さまざまな臓器と隣接していますので発見されたときには、転移・浸潤、周囲の血管を巻き込んでいる症例もあり、そのため切除不能と診断される場合も多くます。
長期生存をもたらす唯一の方法は、術前化学療法(ネオアジュバント)をおこない、その後にがんをすべて取り切る根治手術を行うことです。しかし、術後補助化学療法をしても再発をしてしまう可能性も高く、切除可能境界の定義は今も難しい現状があります。切除不能と診断された場合には、化学療法、放射線療法で対処することになりますが必要以上の治療をおこなうと今度は、副作用により体の機能が落ちてきます。
遺伝子の変異で細胞が、がん化すると、がん細胞は細胞分裂して増殖していきます。細胞分裂のスピードが速いものは悪性度が高く、遅いものは悪性度が低いと考えられます。
転移のメカニズム「治らないがん」なのか「治るがん」から「治らないがん」に移行するのか
転移のメカニズムは、まだ完全に解明されていませんので最初から「治らないがん」なのか「治るがん」から「治らないがん」に移行するのか、確定診断したときにもわかっていません。術前、術後の抗がん剤の投与、手術の術式などの治療法だけではなく、がんが転移しない人もいれば、転移する人もいることになります。
がんの原発巣が数ミリの状態でも転移する性質のがんは、転移していると考えると矛盾がありません。細胞分裂の速度は、あるときから急加速していく可能性もあります。たとえば、私たちの体は子供の頃はものすごい勢いで成長して、大人になると成長がとまります。がん細胞も一定の細胞分裂の速度で増殖するわけではありません。
それと同じように、ある時期、急激に成長する可能性もあれば、ある時期から成長がゆっくりになる可能性もあります。がん細胞の種類を明確に分けることは難しいのです。
細胞分裂がゆっくりで、周囲の組織に浸潤することも転移することもないがん種のタイプと、微小な状態でも浸潤や転移をするタイプに分かれます。早い時期から浸潤や転移を起こすタイプは、どんな治療をしても治癒することは難しくなります。
局所転移(原発巣付近に転移するもの)領域転移((局所リンパ節に転移するもの)遠隔転移(原発巣より離れた遠隔部位に転移するもの)する性質のがんは最初から決まっていると考えますが発見したときにはわかりません。
手術は完璧におこなわれても術後、再発するからです。リンパ行性転移(リンパ流に沿って転移するもの)血行性転移(血流に沿って転移するもの)播種(腹腔や胸腔といった漿膜を突き破って他の漿膜面に転移するもの)も同じです。
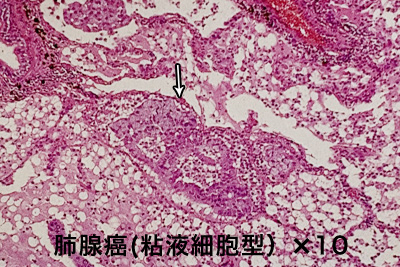 「分化度」は、がん細胞が本来の正常な細胞の形態をどれくらい維持しているかの状態です。
「分化度」は、がん細胞が本来の正常な細胞の形態をどれくらい維持しているかの状態です。
写真は【免液細胞型腺癌】組織学的に印環細胞の密な集族からなり、肺ではこの型の腺癌は稀です。
胃でみられる印環細胞癌に類似しています。印環細胞癌の細胞は、細胞質に大量の粘液を含み、腫瘍の成長と拡散を促進する可能性があり、そのため印環細胞癌は進行が早く、予後が不良であることが多いです。印環細胞癌は、胃癌に最も多く、ついで食道、大腸、乳腺、膵臓など他の臓器にも発生します。
「未分化」「低分化」「高分化」などと表現しますが、分化度の低いがん細胞は、悪性度が高く活発に増殖する傾向があります。難治性のがんです。
しかし、その性質が発生直後か、あるいはその後のなんらかの影響によるものかはわかっていません。急速に変異して悪性度が高まってしまうこともありますので、がんと確定診断されると標準治療では経過観察とはなりません。放置を進める医者もいましたが、否応なく要治療の判断を迫られることになります。
がん幹細胞
手術後に再発がわかって抗がん剤や放射線療法で、急速に増殖する「がん細胞」を一時的に減らすことができても、正常細胞と同じくらい増殖が遅く正常な組織に紛れている「がん幹細胞」には効果がありません。がん幹細胞から再びがん細胞が生じ増殖、増悪を起こすと考えられます。 死に至るがんはほとんど転移がす。
転移するとがん悪液質の誘引になります
転移することで増殖増悪するからです。より生命活動をスムーズに行うための成分、電解質の異常が起こります。体の水分の保持や浸透圧を調整することができなくなり、結果的に腎機能、肝機能の低下を誘発します。
「がん悪液質」により、タンパク質分解誘導因子の関与や神経内分泌系の異常に大量の「炎症性サイトカイン」「インターロイキン6」が分泌されます。筋肉のタンパク質がアミノ酸、ブドウ糖に分解され血中に入りがん細胞の栄養源になるので増殖、増悪の原因になります。
※サイトカインはインターロイキンや腫瘍壊死因子(TNF)などがあり、がん細胞の増殖抑制も担っています。
さらに、肝臓で作られるヘモグロビン量が低下して「がん性貧血」などの悪影響を引き起こす原因となっています。がんによって筋肉量が減少していき衰弱してきます。食事以外の栄養介入(カロリー補給)しても悪液質は緩和されません。悪液質に対する薬物療法の効果は限定的です。
悪液質の認知度は低くよく理解されていません。サイトカインを介する全身の炎症状態として捉えら れてはいますがメカニズムの解明には至っていません。
がん悪液質(あくえきしつ)
トルソー症候群よる脳卒中
がん細胞が分泌する物質、ムチン(気管、消化管などの内腔を覆う粘液)やサイトカイン、血液凝固因子などが原因で血液がドロドロの状態になり、血栓ができ、トルソー症候群よる脳梗塞を引き起こすこともあります。
がんに有効な薬剤は出現するか
 変異遺伝子の解明
変異遺伝子の解明
細胞のがん化は突然変異ですが、遺伝子に傷がつくことにより長い間に徐々に遺伝子変異の蓄積があり、これを多段階発がんと呼んでいます。
正常細胞も日々分裂していますし、がん化した細胞は“細胞周期” の異常により正常細胞より速く増殖します。
がんの原因となる変異遺伝子を解明すれば、がん化した細胞についても原因がわかるはずだ、と考えられていました。 ゲノムの全塩基配列(GATCのならび)を解析するヒトゲノム計画は国際的な大プロジェクトになっていました。ペプチドと結合したアミノ酸群、転写されるmRNA(メッセンジャーリボ核酸)など多くのことも解明されました。
※新型コロナのワクチンで有名になりましたmRNAですが、それ以前からがん基礎研究の分野で開発がおこなわれていました。
がん関連遺伝子
がん化した細胞はどれも似ている細胞の集合体と考えられていました。1例ですが人間の細胞一つの遺伝子数は20000くらいですが、がん関連遺伝子(ドライバー遺伝子)は、その中の300くらい確認されています。がん関連遺伝子に変異がおこると発がんの可能性があることがわかりました。変異遺伝子の組み合わせは、推測さえできない数値になります。
さらにがん巣は、増殖している間に性質の違った様々ながん細胞の集合体であることがわかってきました。がん細胞の多様性があり一人一人のがんは、すべて異なっていて変異し続けています。元になるがん幹細胞の存在があるからです。増殖に伴って変異した細胞になりますので、全てではありませんが分子標的薬の有用性もがん細胞の多様性により限界があります。
だからどうしても、いくつも薬剤を組み合わせないと、がん組織はは叩けないことになります。非現実的な話になりますが何百どころか、何千種類もの薬剤が必要と推測されています。薬物療法でがん細胞の増殖を抑えたりする治療は全身療法になり、長期にわたり投薬が必要になり、正常な細胞までダメージを与えてしまいます。転移するがん細胞をターゲットにした転移阻害剤は、開発されていません。
遺伝子検査
近年、がん発生に関わるタンパク質の抑制をするために、ゲノム(遺伝子と染色体を含むDNAのすべての遺伝情報)解析に基づいた医療が行われています。がん遺伝子検査(がん遺伝子パネル検査)において治療の選択肢(薬物療法)を広げる可能性もありますが、ゲノム医療は始まったばかりで発展段階にあるため遺伝子の変異はわかっても、それに対する治療薬の対象になるがん種は、まだ10〜15%と少数です。
酵素を用いて遺伝子操作を行うゲノム編集(遺伝子を改変する技術の一つ)の試みもあります。変異遺伝子を取り除くことや別な遺伝子を挿入したりすることもできます。しかし、完全な技術ではなく意図しない変異を起こすこともありヒト遺伝子では確立されていません。「遺伝子治療」は確立されていません。
難治性のがん治療において有効な抗がん剤は限られており、治療薬の開発が急がれています。 最先端のがん治療である量子療法や核医学療法、プレシジョン・メディシン(精密医療)など、 正常細胞を傷つけずにがん細胞のみを狙い撃ちすることができる治療の確立に期待したいところです。
分子標的薬
分子標的薬は、がんの増殖に関係したりする分子(タンパク質など)に標的を定めて開発された薬剤ですが、多様ながん細胞の組織だと全ての細胞を排除することは難しく、効果を発揮できない場合もあります。分子標的薬はがん細胞の増殖に関わる特定の分子に狙いを定めて増殖を抑えます。事前にがんの治療薬に関わるバイオマーカー(治療に対する反応をみる指標)について知ることは、がん種に合った最適な治療を受け、不要な副作用を避けることにつながります。また、治療効果が期待できるかどうかを判定できます 。
免疫チェックポイント阻害剤
免疫チェックポイント阻害薬を使う免疫療法は、体内のT細胞(免疫)は、がん細胞を抑制、排除する働きがあります。がん細胞から免疫細胞に結合してT細胞(免疫)を抑制した状態にします。そうすると、免疫機能が働かずがん細胞は排除されなくなります。それを本来の免疫の状態に戻します。しかし、一部のがん種にしか適用にはなりません。また、一般的な抗がん剤とは違った副作用が出ることもわかってきています。
理想は、がん細胞のみにダメージを与えてがん細胞をアポトーシス(細胞自体に組み込まれたプログラムにより排除される) ことができる方法なら副作用のない有効的な治療法の開発も期待できるのですが実際には実用化には至っていません。
分子標的薬や免疫チェックポイント阻害剤など多くの薬剤が登場しましたが、固形がんの場合、治療の第一選択にはなっていません。手術で完治を目出すことが優先されます。
手術ができない場合がんとの共存、延命が目的になります。がんの遺伝子変異に対して効果が期待できる抗がん剤がある場合には、その薬剤の使用を検討する時代ですからmRNAを利用した、がん治療の治験もアメリカでは始まっています。
術中迅速病理診断
手術は、取り残しを防ぎ機能温存を考慮しがん巣を摘出します。原発以外に術中の肉眼的所見でも確認できないほど小さながん組織があると、再発する可能性が高くなります。そのため疑わしい場合手術中に病変部の一部や切除断端を病理検査にだします。 腫瘍の取り残しがないか、リンパ節転移が無いかなど病理医の顕微鏡を用いた“術中迅速病理診断”に基づいて執刀医は切離、切除範囲を決定することができます。もし断端に腫瘍が見つかれば、追加で切除をおこなったり術式を変更して高侵襲手術(拡大切除)に移行します。それでも、手術だけではすべてのがんの再発は防ぐことはできません。
集学的治療
集学的治療で完治を目指すことになりますが放射線は周囲にある正常な細胞にも影響を与えてしまいます。一定の線量以上は照射できません。手術療法にしても、放射線療法でも完治を目指す治療です。30年以上前から第一選択として行われてきました。手術・放射線療法が第一選択とならない場合、分子標的薬、免疫チャック阻害剤などの抗がん剤で対処します。
光免疫療法
「光免疫療法」近赤外線免疫療法は、がん細胞のみの細胞膜に接着する薬剤の精度と光線効果が引き金となって体内の免疫が強く活性化され、がん細胞の破壊を期待されている治療です。 国立がん研究センター東病院をはじめ、臨床試験が進められています。一部のがんで保険適応にはなりましたが治療を希望しても治療は、なかなかうけられません。がん細胞の特定タンパク質を活性化させ光を照射することでがん細胞にダメージを与える治療法は研究段階です。
※身体には、異常が出た細胞がアポトーシスすることで機能を正常に維持する仕組みがあります。 アポトーシスしないのが「がん細胞」で無限に分裂増殖しす。アポトーシスした細胞は、マクロファージ(食細胞)によって処理され体外に排出されます。
早期発見の意味
 早期がんといわれる時期に手術して切除、摘出して、標本を病理検査などをしてもその後100%再発するかしないかわからないのです。
早期がんといわれる時期に手術して切除、摘出して、標本を病理検査などをしてもその後100%再発するかしないかわからないのです。
1cmの早期がんと呼ばれる状態で仮に発見されたとしてもがんの寿命(生命の危険を伴う大きさ)としてはすでに4分の3を経過しています。
実は2mm程度の大きさが分岐点なのです。がんがそれ以上の大きさに成長するには新たな血管が必要になります。血管新生がおこったがんは急速に増大しはじめる傾向にあると考えられます。
固形がんの場合はCT、PETなど最新の検査機器を用いても診断できる大きさは5mm程度です。それ以下の大きさでは画像上発見できません。
また悪性度の高い浸潤がんはすでに5mm以下の状態でも細胞レベルで遠隔転移をおこしている可能性があります。1cmで約10億位のがん細胞の塊になります。
しかしながら転移能力のないがん細胞は仮に5cm位になっても転移はしません。がん細胞が1cmになるまでは遺伝子変異する可能性はありますが、その時点で転移がないものは仮に5cmになっても転移はおこさない可能性が高いです。
その一方ではいくら小さい状態で発見され手術をしても転移するものはすでにしています。それが腫瘍マーカーや細胞診などで術前に分かれば良いのですが転移するのか、しないのか病理の分野でもまだはっきりしたことが100%分かりません。
治療成績が上がったようにみえるのは診断機器や技術の向上で見つかった多くの早期がんと呼ばれている状態で発見され、治療するからです。「治るがん」と「治らないがん」があるとお伝えしましたが、「治るがん」を治療している症例もあるのかもしれません。
たとえば消化器のがんが浸潤する場合は粘膜下層、固有筋層まで浸潤しさらに腹膜まで浸潤するのはがん細胞の遺伝子に特殊な能力が備わっていると考えられます。
ですから粘膜内あるいは固有筋層までで止まっているがんというものは元々そういう能力しかないがんだと思います。浸潤する能力をはじめから備わっていないがん細胞は命を脅かす事態にはならないと思います。
「がんは徐々に広がっていってあるところまでいくと遠隔転移して、全身に広がる」という考え方は相当前に否定されています。
どこの部位に発生したがんでもいまや拡大手術から縮小手術に変わってきました。つまり拡大手術も縮小手術も治癒率は変わらないということです
例外的にリンパ節を広範囲に郭清をする拡大手術をうけて、おそらく再発すると思われた例でも再発をしないで治癒した例もあります。
その逆に早期といわれる1期の場合でも数年後に再発をおこすこともあります。手術可能ながんに対しては術者は根治手術を目指しますが、すでに微小ながん細胞が転移していた場合は数年のうちに転移がおこる可能性があります。
例外はありますが相互的に勘案してがん巣の取り残しがないなら、手術で使うデバイス(止血しながら組織を剥離する器具、手縫いに置き換わる自動縫合器など)の進化もあり、術者の技術による差が少ない縮小手術に移行してきました。
早期がん、進行がんで再発もなく治癒した場合には手術が有効だったといえます。しかし手術は成功したのにその後再発することもあります。「がん幹細胞」は抗がん剤や放射線への抵抗性を有しているため再発・転移の原因となっていると考えられ、がん治療の難しさをあらわしています。
確かに早期で見つけることは理論的に悪くはないと思いますが、総合的に考えて利益があるかどうか難しいところです。一般的に「早期発見」「早期治療」を訴えていますが、検診を受けることで、どれだけ利益があるのか、あるいは、どれだけ不利益があるのか、という説明は、あまり成熟しているとは思えません。
検診で見つかる多くの早期がんは、進行がゆっくりで、検診で見つけなくても自覚症状があって受診してからの治療でも治癒率は変わらないので検診によって、細胞分裂のはやい進行がんを、早期の段階で発見することは無理があります。 検診で、早期発見しても、ただ、早期がんが増えるだけであって、進行がんが減ったり、死亡数が減ったりすることは、ありません。 結果、治療しなくてもいい症例の人もがんと診断され罹患率が増えつづている現状があります
一番知りたいのは、検診で、発見されたとき治療を受けるのか、経過観察(サーベイランス)がベストなのかの、エビデンス(科学的根拠)がわかっていません。自覚症状が無い非浸潤性(上皮内にがんがとどまっている)症例でもほぼ手術の対象になりますので、自覚症状がないがんを発見した場合、治療の必要のないがんも手術適応になることもあります。そのまま経過観察になることは非常に少ないです。
ステージが進んだ状態で発見された患者さんが、1年あるいは2年前にがんと診断され治療を受けていたから治ったとも簡単にはいえません。
悪性度の高いがんは仮に1cmの状態で発見されても、既に転移しているからです。
がん検診を受けない人の選択も社会として尊重すべきです。 また検診で、総死亡率を減らす効果はないという事実を率直に認めることも大切です。
一方転移しないがんはそのままの状態でいることも知られています。増殖しても転移しないがんは早期発見でなくても、手術や放射線治療で治ります。
がん検診技術は、目ざましく進歩していますが身体にはがんはありませんということではありません。発見できないがんも多くあり、偽陽性の場合不必要な検査につながることもあります。
がん検診のメリット(利益)ばかりを強調しないで、デメリット(不利益)も知らせてほしいと思います。
がんの検診にも新しいコンセプトが必要かも知れません。そのため、健康診断の「人間ドック」では、有用性が疑わしい検査には何らかのガイドラインがやっと適用されます。
「過剰診断」や「過剰治療」の問題もあるため健康診断も見直しされています。早期といわれる時期に発見することも限界があるかもしれません。極端ないい方をするとがんの病変が発見されたとき「治るものは治るし、治らないものは治らない」としか言わざるをえない状況は何十年も変わっていません。
頼れるがん治療アドバイザーを目指します
がん治療は専門的な知識や判断が必要であるため、画像検査(CT・MRIなど)病理検査(採取された病変組織の病理学的診断)など踏まえた上で院内カンファレンス(病状検討会)を経て、最終的に主治医からがんの告知を受けます。その後、治療法について十分な説明を受けます。それに対して患者さんは内容をよく理解して疑問があれば解消し、納得した上で医療行為に同意します。
しかし、がんの告知を受けた患者さんは精神的にもかなり深刻な状態です 冷静な判断力を失っている場合も多いと思います。丁寧な説明を受けても、それを理解するまでには時間がかかります。
患者さん自身が治療に関して理解を深め、納得した上で選択した治療を進めることができるよういつでもサポートできるアドバイザーになりたいと思っております。悔いの無い治療を心より願っております。
がんの治療は、医師と患者さんとご家族の方の密接な連携が何より大切です。インフォームド・コンセント((納得と治療の選択)の普及の一助となれば大変意義深いことと考えております。
がん治療の現状 手術(外科療法)
がん治療の現状 薬物療法(抗がん剤)
がん治療の現状 放射線療法
がん治療の現状 がん治療の難しい理由
がん治療サポート内容 最善のがん治療を受けるために
「がん治療相談」がん治療アドバイザーによるサポート
オピニオン(がん治癒への道)
がん標準治療を選択するとき
「がん標準治療」生存率
がん先進医療(精密医療)
がん免疫療法
がん発生メカニズム
がん再発・転移
がん幹細胞
がん悪液質(あくえきしつ)
がん遺伝子治療
標準治療以上に自由診療の治療成績がよいということではありません
新型コロナウイルの基本知識